Infarmed diz que não recebeu pedido do Hospital Santa Maria para medicamento de jovem com doença rara
05 mar, 2021 - 17:35 • João Carlos Malta com Lusa
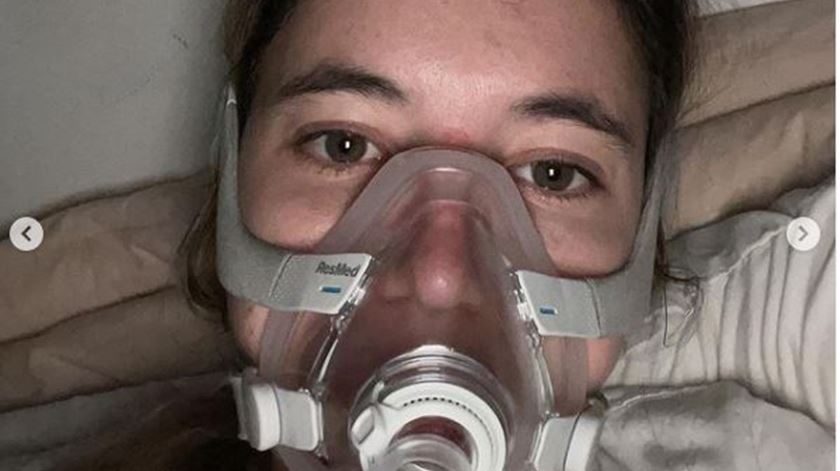
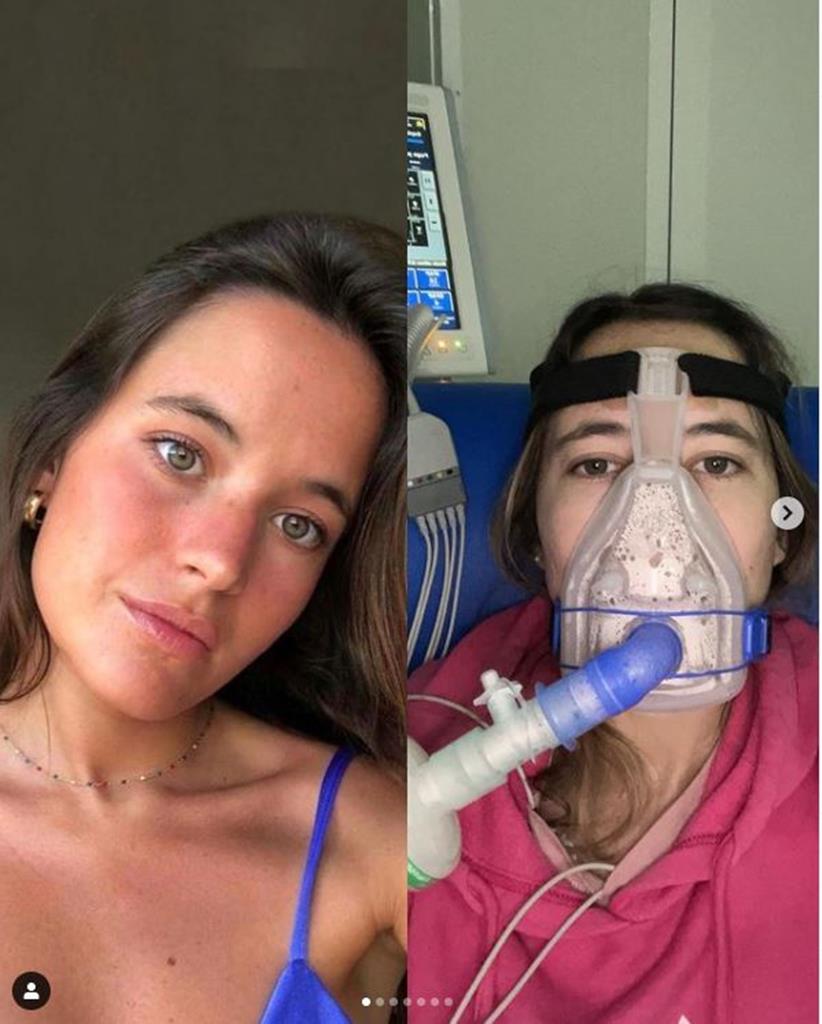
Constança Braddell, de 24 anos, tem fibrose quística. Luta por ter acesso a um medicamento que lhe pode dar qualidade de vida, e acusa o Infarmed de nada fazer para a ajudar. Autoridade do Medicamento garante: "não iremos ficar indiferentes a qualquer pedido que nos seja submetido".
O Infarmed, autoridade nacional do medicamento em Portugal, avança que até ao momento não foi submetido qualquer pedido de Autorização de Utilização Especial de um medicamento ainda não comercializado em Portugal, para Constança Braddell. A jovem de 24 anos tem uma doença rara: fibrose quística. A mesma autoridade do medicamento diz que esse facto foi "confirmado pelo hospital".
A jovem, numa publicação nas redes sociais, diz que luta para que lhe seja dado pelo Infarmed e pelo Ministério da Saúde a possibilidade de ter acesso a um novo medicamento − que no caso dela lhe pode dar boas possibilidades de ter mais anos de vida com qualidade. Mas até agora não teve nenhuma resposta que lhe dê alento e esperança. “Todas as noites vou dormir aterrorizada de não acordar na manhã seguinte – e tudo porque o Infarmed escolheu virar-me as costas”.
Através de uma publicação desesperada numa rede social começa por pedir: “Não quero morrer, quero viver”.
O medicamento em causa é o Kaftrio e o Infarmed esclarece em comunicado enviado às redações põe a bola do lado do hospital. Afirma que "enquanto decorre a sua avaliação (cujo objetivo é garantir o acesso de todos os cidadãos, quer às terapêuticas inovadoras, quer aos demais cuidados que necessitem no contexto do SNS), existe a possibilidade de acesso ao medicamento", mas que a mesma é de "iniciativa do hospital".
Para isso diz ser necessário uma Autorização de Utilização Especial (AUE), ao abrigo de um Programa de Acesso Precoce, no caso deste medicamento aprovado em 27 de novembro de 2020.
"Os pedidos de AUE são fundamentados pelo hospital requerente, e incluem informação clínica detalhada do doente para o qual é solicitado o tratamento. Essa informação é depois avaliada caso a caso por peritos clínicos (médicos), pertencentes à Comissão de Avaliação de Tecnologias de Saúde do Infarmed", avança o Infarmed.
A mesma instituição diz que apesar de, no contexto da proteção de dados dos doentes, "os pedidos de AUE serem anónimos", após novo contacto da doente, "o Infarmed contactou o hospital que a segue [Santa Maria, no sentido de verificar se existia de facto um pedido pendente e, se necessário, apoiar o hospital nesse processo".
Mas que até agora, daquela unidade não receberam nenhum pedido.
O que diz o Santa Maria
O Hospital de Santa Maria, em Lisboa, onde Constança é seguida em resposta às perguntas da Renascença, esclarece que o Centro Hospitalar Universitário de Lisboa Norte (do qual o Santa Maria faz parte) "fez um pedido para utilização de um fármaco acabado de aprovar no nosso país, que se aplica na situação clínica da doente, e espera decisão do Infarmed para a sua utilização”.
O medicamento em causa não é o que a mulher refere na mensagem do Instagram, mas um outro: o Orkambi.
“Um pedido que se insere numa rigorosa avaliação dos critérios clínicos e no melhor seguimento da doente em causa”, explica a mesma unidade hospitalar.
O mesmo centro hospitalar esclarece ainda que em relação ao tratamento citado nas redes sociais, o Kaftrio comercializado pela Vertex Pharmaceuticals, empresa com sede na Irlanda, ainda está em fase de avaliação em Portugal. O objetivo, garante o Hospital Santa Maria é incluir também a doente numa segunda fase do Programa de Acesso Precoce (PAP), uma plataforma para aceder a medicamentos ainda sem autorização de introdução no mercado.
Mas porque é que ainda não o fez? O CHULN afirma que utilizou as duas autorizações de PAP que lhe foram atribuídas em relação a este medicamento numa primeira fase e que aguarda a informação do Infarmed sobre este processo.
Ora o Infarmed afirma que não teve qualquer contato do hospital onde a jovem é acompanhada.
Jovem com doença rara luta por medicamento: “Não quero morrer”
Constança Braddell tem fibrose quística e escreveu(...)
Em comunicado, o Infarmed acrescenta também que a obtenção de AIM (autorização de introdução no mercado) para os medicamentos inovadores, é atribuída em regra pela Comissão Europeia, após parecer da Agência Europeia de Medicamentos. Após esta fase, e para que possam ser utilizados e financiados pelo SNS, os medicamentos devem demonstrar vantagem terapêutica e vantagem económica face à prática clinica nacional, de forma a garantir o acesso de todos os cidadãos quer às terapêuticas inovadoras, quer aos demais cuidados que necessitem no contexto do SNS.
Há dois medicamentos no mercado para esta doença
Em 2021 foram aprovados dois medicamentos inovadores para o tratamento da fibrose quística. "Assim, e de forma a assegurar o acesso dos cidadãos nos casos excecionais em que se verifique a ausência de alternativa terapêutica, enquanto esta avaliação decorre, os medicamentos poderão ser utilizados mediante autorizações excecionais (AUEs), as quais, desde setembro de 2017, são efetuadas ao abrigo de Programas de Acesso Precoce a Medicamentos (PAP).
Relativamente ao medicamento Kaftrio, aprovado pela Comissão Europeia a 21/08/2020, o Infarmed sublinha que a avaliação se iniciou ainda antes da atribuição da AIM, após o parecer da Agência Europeia de Medicamentos (EMA). "Com essa informação inicial, e nos termos da legislação em vigor, a empresa submeteu em dezembro, formalmente, o pedido de avaliação para efeitos de financiamento público, e no final de janeiro, submeteu a documentação solicitada pelo Infarmed para que possa ser efetuada a referida avaliação, adianta em comunicado.
Mais acrescenta ainda que de forma a garantir o acesso dos cidadãos ao medicamento, foi aprovado pelo Infarmed, em 27 de vembro do ano passado, um Programa de Acesso Precoce, ao abrigo do qual foram já aprovados 8 dos 10 pedidos de AUE submetidos. Os dois pedidos que aguardam decisão foram submetidos recentemente, e encontram-se em avaliação.
Por fim, e nunca citando as acusações de Constança afirmam que enquanto "Autoridade Nacional do Medicamento não iremos ficar indiferentes a qualquer pedido que nos seja submetido".
"Nunca ficámos. O nosso trabalho ao longo destes 28 anos tem-se sempre pautado pelo diálogo, pela transparência e pela confiança que proporcionamos ao sistema de saúde e à sociedade", rematam.
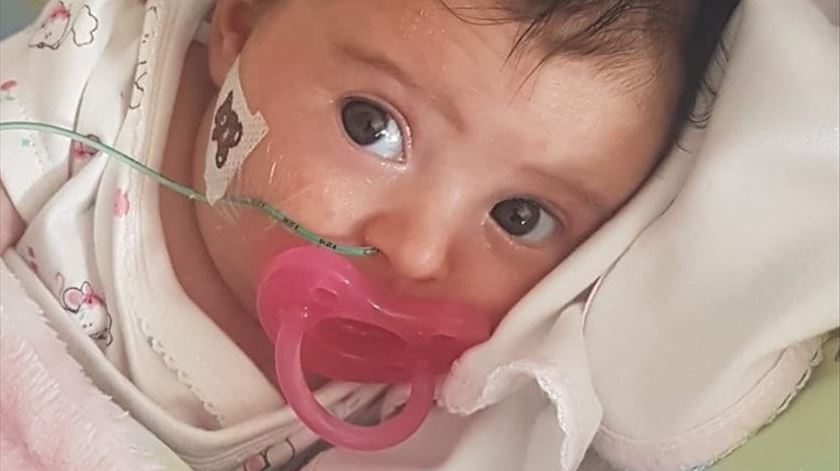
Pais da bebé Matilde já ajudaram 38 crianças com problemas de saúde
A menina, que nasceu com atrofia muscular espinal (...)
Caso chega à política
Entretanto, o caso já chegou ao domínio partidário. O PSD quer ouvir no parlamento várias entidades ligadas à fibrose quística e o Infarmed, de forma a esclarecer “dúvidas” sobre a não autorização em Portugal de novos fármacos para esta doença.
No requerimento entregue, esta sexta-feira, o grupo parlamentar do PSD pede a audição, na Comissão parlamentar de Saúde, da Associação Nacional de Fibrose Quística, da Associação Portuguesa de Fibrose Quística, do Conselho de Administração do Centro Hospitalar Universitário de Lisboa Norte e do Instituto Nacional da Farmácia e do Medicamento.
Os deputados do PSD referem no texto que, apesar de ao longo dos últimos cinco anos terem surgido novas terapêuticas para tratamento da fibrose quística, “lamentavelmente, as mesmas ainda não se encontram disponíveis em Portugal, razão pela qual não podem ser administradas no nosso país sem autorização expressa do Infarmed”.
“Acresce que, em 2019 surgiu um novo fármaco, que demonstrou melhorar significativamente o prognóstico da fibrose quística, diminuindo as exacerbações pulmonares, internamentos hospitalares e melhoria da função respiratória e a qualidade de vida dos pacientes”, apontam os sociais-democratas, assinalando que, apesar de já estar provado em países europeus como Inglaterra, França e Suíça, continua a aguardar aprovação em Portugal.
No requerimento, assinado à cabeça pelo ‘vice’ da bancada e médico Ricardo Baptista Leite, o PSD assinala que “recentemente têm sido noticiados casos de grave sofrimento humano associado à inacessibilidade dos doentes às referidas novas terapêuticas”, ao mesmo tempo que “se avolumam dúvidas no que se refere aos procedimentos de autorização de administração desses novos fármacos, designadamente envolvendo o Infarmed e o Centro Hospitalar Universitário de Lisboa Norte”.
Também hoje, o PS entregou uma resolução no parlamento apelando ao Governo socialista para acelerar o processo de aprovação de um medicamento para a fibrose quística pelo Infarmed.